Адреногенитальный синдром: заболевание у новорожденных
Содержание:
- Симптомы адреногенитального синдрома
- Что провоцирует / Причины Адреногенитального синдрома:
- Лечение патологии
- Лечение адреногенитального синдрома
- Адреногенитальный синдром у новорожденных
- Симптомы
- Особенности симптоматики
- Механизм развития
- Профилактика
- Скрининг и другие методы диагностики
- Причины
- Механизм развития
Симптомы адреногенитального синдрома
При врожденной форме адреногенитального синдрома еще в период внутриутробного развития при формировании гормональной функции надпочечников вырабатывается излишнее количество андрогенов. Избыток андрогенов приводит к возникновению половой дифференцировки, относящейся к плоду женского пола. К 9-11 неделе внутриутробного развития плод уже имеет половое строение и органы, характерные для женского организма, хотя наружные половые органы на данном этапе еще только начинают формироваться. При этом женский фенотип формируется из начального типа.
На женский плод и его наружные половые органы оказывает влияние чрезмерная выработка тестостерона, в итоге происходит значительное увеличение полового бугорка, который затем принимает форму пенисообразного клитора, лабиосакральные складки сливаются и по форме напоминают мошонку. Урогенитальный синус открывается под деформированным клитором, не распределяясь изначально на влагалище и уретру. Поэтому при рождении ребенка зачастую неправильно определяют его половую принадлежность. Так как гонады яичники приобретают женскую форму, врожденный адреногенитальный синдром нередко называют ложным женским гермафродитизмом, в период внутриутробного развития гиперпродукция андрогенов приводит к гиперплазии надпочечников.
Дети, страдающие таким заболеванием, нуждаются в постоянном контроле со стороны детских эндокринологов. Современные медицинские методики предусматривают своевременное хирургическое лечение адреногенитального синдрома, чтобы операционным путем произвести коррекцию пола и в дальнейшем ребенок развивался по женскому типу. Сейчас к гинекологам-эндокринологам нередко обращаются пациентки, у которых адреногенитальный синдром характеризуется поздней формой.
При пубертатной врожденной форме дефицит С21-гидроксилазы проявляется в период внутриутробного развития еще во время пубертатного периода, когда только проявляется гормональная функция коры надпочечников. Однако нарушения особенно заметны непосредственно перед наступлением у девочки первой менструации. И если обычно в популяции первая менструация протекает в 12-13 лет, то у девочек с врожденным адреногенитальным синдромом, характеризующимся пубертатной формой, первая менструация наступает значительно позже, лишь в 15-16 лет.
Менструальный цикл при данном заболевании достаточно неустойчив, менструации протекают нерегулярно, у девочек возникает тенденция к олигоменорее. Промежуток между менструациями значительный, как правило, он составляет 30-45 дней.
Гирсутизм довольно ярко выражен, довольно часто он проявляется в росте стержневых волос, расположенных по белой линии живота, в росте волос над верхней губой по мужскому принципу, на бедрах и вокруг сосков. На теле появляется большое количество сальных желез, нередко наблюдается нагноение волосяных фолликулов, кожа на лице становится жирной, поры увеличиваются и расширяются. Девушки, страдающие пубертатной формой адреногенитального синдрома, отличаются довольно высоким ростом и мужским телосложением, широкими плечами и узким тазом, наблюдается гипопластичность молочных желез. Как правило, главными жалобами таких пациенток при обращении к медикам становится возникновение угревой сыпи либо жалобы на нерегулярный менструальный цикл.
При данной постпубертатной форме заболевания симптомы адреногенитального синдрома у девушек заметны лишь после полового созревания. Довольно часто симптомы становятся ярко выраженными после медицинского аборта, во время неразвивающейся беременности либо после самопроизвольного выкидыша. Выражается в нарушении менструального цикла, промежутки между менструациями значительно увеличиваются, менструальные выделения становятся скудными, нередко возникают задержки.
В данном случае гиперандрогения характеризуется относительно мягкими признаками проявления, гирсутизм почти не выражен и проявляется лишь в незначительном оволосении на белой линии на животе, немного волос может быть на голенях, около сосков, либо над верхней губой. Молочные железы у девушки развиваются таким же образом, как у ее сверстниц, телосложение формируется по женскому типу, метаболических нарушений не проявляется.
Что провоцирует / Причины Адреногенитального синдрома:
Ген фермента 21-гидроксилазы расположен на коротком плече хромосомы 6. Существует два гена — активный ген CYP21-B, кодирующий 21-гидроксилазу, и неактивный псевдоген CYP21-A. Эти гены в значительной мере гомологичны. Наличие рядом с кодирующим геном гомологичной ДНК-последовательности зачастую ведет к нарушениям спаривания в мейозе и как следствие этого — к конверсии генов (перемещение фрагмента активного гена на псевдоген), либо к делеции части смыслового гена. В обоих случаях функция активного гена нарушается. На хромосоме 6 рядом с генами CYP21 находятся гены HLA, которые наследуются кодоминантно, в результате чего у всех гомозиготных сибсов будет определяться идентичный HLA-гаплотип
Лечение патологии
Лечение адреногенитального синдрома осуществляют главным методом терапии вирильной дисфункции надпочечников. Таким методом лечения считается заместительная терапия гормонами для восполнения недостатка глюкокортикоидов.
При скрытой форме болезни, если женщина не хочет забеременеть на данном этапе, менструации проходят ритмично, гормональные препараты применять не стоит. В других случаях, как проводить терапию, решают в зависимости от симптомов заболевания. Нередко глюкокортикоидные лекарства применяют в комплексе с другими препаратами.
Как лечат бесплодие
При желании женщины стать мамой следует принимать глюкокортикоиды до момента восстановления регулярных менструаций и после этого, пока не наступит беременность. Чтобы не произошел выкидыш, лечение гормонами продолжается до окончания 12 недели беременности. Если в начале беременности проводят терапию эстрогенами, то в последующее время применяются аналоги прогестерона, не имеющие андрогенного эффекта.
Как корректировать нерегулярные менструации
Если женщину беспокоят нерегулярные месячные, высыпания на кожных покровах, гирсутизм, а беременеть она не желает, принимать необходимо препараты с эстрогенным и антиандрогенным действием. Рекомендуются также контрацептивные препараты, в состав которых входят гестагены. Результат терапии можно увидеть через полгода, но со временем, когда заместительная терапия прекращена, происходит восстановление признаков гиперандрогении.
Терапия ложного гермафродитизма
Заболевание лечат гормонотерапией и хирургическими способами корректируют форму половых органов. Также назначается терапия минералокортикоидами. Нередко выдаются случаи, когда новорожденная девочка с нераспознанным заболеванием регистрируется как особа мужского пола.
 В таких случаях можно восстановить половую идентичность при помощи хирургической пластики, провести курс гормонотерапии, а также психотерапевтического лечения
В таких случаях можно восстановить половую идентичность при помощи хирургической пластики, провести курс гормонотерапии, а также психотерапевтического лечения
Лечение адреногенитального синдрома
Лабораторное и инструментальное подтверждение диагноза является обоснованием для проведения адекватной заместительной гормональной терапии с применением препаратов глюкокортикостероидного ряда.
Назначение любого глюкокортикостериода обязательно должно быть строго дозировано и подконтрольно лабораторным показателям крови и мочи. Применение Дексаметазона в суточной дозе 0,25 мг следует производить до момента устранения основных клинических проявлений заболевания (нормализация цикличности базальной температуры, устранение дисменореи, эхоскопически подтвержденное устранение мультифолликулярности яичников). Абсолютным критерием положительной эффективности гормонотерапии в этом случае является наступление запланированной беременности, однако данный факт не является показанием для прерывания приема препарата. Дексаметазон в период беременности целесообразно применять до момента формирования плаценты, которая обеспечивает нормализацию гормонального статуса плода.
Женщины, у которых период наступления беременности совпал с приемом гормональных препаратов глюкокортикоидного ряда, подлежат госпитализации в стационар с целью проведения динамического ультразвукового исследования, а также определения концентрации 17-кетостероидов в моче. Наличие у беременной женщины, принимающей гормональную терапию с целью лечения адреногенитального синдрома, самопроизвольных абортов в анамнезе является обоснованием для назначения эстроенсодержащих гормональных средств, действие которых направлено на улучшение поступления оксигенированной крови к развивающемуся плоду. Среди широкого спектра этой группы лекарственных средств наибольшее распространение получил Микрофоллин, эффективность которого максимальная в терапевтической дозе 0,25 мг в сутки. Появление у женщины кровянистых выделений или тянущих болей в нижней части живота является показанием к отмене препарата.
В связи с тем, что женщины, страдающие адреногенитальным синдромом, имеют проблемы с вынашиванием плода и склонность к возникновению самопроизвольного выкидыша на раннем сроке беременности, целесообразным в данной ситуации является назначение природного аналога прогестерона «Дюфастона» в суточной дозе 20 мг. Длительный прием данного препарата устраняет истмикоцервикальную недостаточность, которая является самой распространенной причиной самопроизвольного аборта.
Препаратом, оказывающим стимулирующее влияние на процесс развития овуляции, является Кломифен, применение которого рекомендуется сочетать с глюкокортикоидной терапией. Пациенткам обязательно необходимо соблюдать режим приема препарата, заключающийся в приеме его в суточной дозе 100 мг с третьего по седьмой день менструального цикла каждый месяц до наступления беременности.
В ситуации, когда признаки адреногенитального синдрома дебютировали в зрелом возрасте, когда женщина не заинтересована в сохранении репродуктивной функции, рекомендуется терапия заболевания с применением комбинированных препаратов, содержащих антиандрогены и эстрогены (Андрокур в дозировке 25 мг). Следует учитывать, что данную группу препаратов относят к категории симптоматических, устраняющих незначительные фенотипические проявления заболевания, и при отмене приема препарата возможно обратное развитие болезни.
Для борьбы с гипергисутизмом гормональная терапия не применяется и в данной ситуации эндокринологи прибегают к назначению Верошпирона в суточной дозе 100 мг утром, длительный прием которого значительно уменьшает проявления избыточного оволосения.
Областью применения гормональных препаратов контрацепции, содержащих низкодозированный гестагенный компонент, лишенный андрогенного влияния, является группа пациенток с признаками поздней постпубертатной формы адреногенитального синдрома. Прежде чем применять данную группу препаратов, следует удостовериться в нежелании пациентки сохранять репродуктивную функцию, так как данные гормональные средства при длительном приеме провоцируют развитие аменореи гипогонадотропного типа.
Адреногенитальный синдром у новорожденных
Заболевание может быть обнаружено на ранней стадии у новорожденных детей, что связано с проведением неонатального скрининга на 4 сутки после рождения ребенка. В ходе теста каплю крови из пятки малыша наносят на тест-полоску: если реакция положительная, ребенка переводят в эндокринологический диспансер и проводят повторную диагностику. После подтверждения диагноза начинается лечение АГС. Если адреногенитальный синдром у новорожденных обнаружен рано, то терапия проходит легко, в случаях позднего обнаружения адреногенетической патологии сложность лечения растет.

У мальчиков
Болезнь у детей мужского пола развивается, как правило, с двухлетнего или трехлетнего возраста. Происходит усиленное физическое развитие: увеличиваются гениталии, осуществляется активное оволосение, начинают появляться эрекции. При этом яички отстают в росте, а в дальнейшем вовсе прекращают развиваться. Как и у девочек, адреногенитальный синдром у мальчиков характеризуется активным ростом, однако он длится недолго и в итоге человек все равно остается низким, коренастым.
У девочек
Патология у девочек зачастую выражается сразу при рождении в вирильной форме. Ложный женский гермафродитизм, характерный для АГС, характеризуется увеличенным размером клитора, при этом отверстие мочеиспускательного канала находится прямо под его основанием. Половые губы в данном случае напоминают по форме расщепленную мужскую мошонку (урогенитальный синус не делится на влагалище и уретру, а останавливается в развитии и открывается под пенисообразным клитором).
Не редко адреногенитальный синдром у девочек так ярко выражен, что при рождении младенца трудно сразу установить его пол. В период 3-6 лет у ребенка активно растут волосы на ногах, лобке, спине и девочка внешне становится очень похожа на мальчика. Больные АГС дети растут гораздо быстрее своих здоровых сверстников, однако их половое развитие вскоре полностью прекращается. При этом молочные железы остаются маленькими, а менструации либо полностью отсутствуют, или же появляются нерегулярно из-за того, что недоразвитые яичники не могут в полном объеме выполнять свои функции.
Симптомы
Сольтеряющий и простой вирильный
При антенатальных формах заболевания основным клиническим симптомом является видимая вирилизация гениталий. У новорожденных девочек обнаруживаются признаки женского псевдогермафродитизма. Клитор большой по размерам или имеет пенисообразную форму, преддверие влагалища углублено, сформирован урогенитальный синус, большие и малые половые губы увеличены, промежность высокая. Внутренние половые органы развиты нормально.
У младенцев-мальчиков увеличен половой член и гиперпигментирована мошонка. Кроме того, при сольтеряющем адреногенитальном расстройстве выражена симптоматика надпочечниковой недостаточности с тяжелыми, зачастую несовместимыми с жизнью соматическими нарушениями (понос, рвота, судороги, обезвоживание и др.), которые проявляются с 2-3-недельного возраста. У девочек с простым вирильным АГС по мере взросления признаки вирилизации усиливаются, формируется диспластическое телосложение.
Из-за ускорения процессов окостенения пациентки отличаются невысоким ростом, широкими плечами, узким тазом, короткими конечностями. Трубчатые кости массивные. Половое созревание начинается рано (до 7 лет) и протекает с развитием вторичных мужских половых признаков. Отмечается увеличение клитора, снижение тембра голоса, нарастание мышечной силы, формирование типичной для мужчин формы перстневидного хряща щитовидной железы. Грудь не растет, менархе отсутствует.
Неклассический
Менее специфичны клинические симптомы при неклассических формах вирилизирующего синдрома, возникшие в пубертате и после стрессовых нагрузок (выкидыша на ранних сроках беременности, медицинского аборта, операции и др.). Обычно пациентки вспоминают, что у них еще в младшем школьном возрасте появилось небольшое оволосение в подмышечных впадинах и на лобке. В последующем развились признаки гирсутизма с ростом стержневых волос над верхней губой, по белой линии живота, в области грудины, в сосково-ареолярной зоне.
Женщины с АГС предъявляют жалобы на стойкую угревую сыпь, пористость и повышенную жирность кожи. Менархе наступает поздно — к 15-16 годам. Менструальный цикл неустойчив, интервалы между менструациями достигают 35-45 дней и более. Кровянистые выделения во время месячных скудные. Молочные железы небольшие. Клитор несколько увеличен. Такие девушки и женщины могут иметь высокий рост, узкий таз, широкие плечи.
По наблюдениям специалистов в сфере акушерства и гинекологии, чем позже развиваются адреногенитальные расстройства, тем менее заметны внешние признаки, характерные для мужчин, и тем чаще ведущим симптомом становится нарушение месячного цикла. При более редких генетических дефектах пациентки могут жаловаться на повышение артериального давления или, наоборот, гипотонию с низкой работоспособностью и частыми головными болями, гиперпигментацию кожи с минимальными симптомами вирилизации.
Особенности симптоматики
Систематизация разных форм адреногенитальных расстройств основана на особенностях клинической картины, выраженности генетического дефекта и времени появления первых признаков.
Сольтеряющая форма – самый тяжелый вариант течения АГС, который проявляется в первые годы жизни ребенка грубыми пороками развития половых органов у девочек и их увеличением у мальчиков. Дети с адреногенитальными расстройствами часто срыгивают, мочатся. Сольтеряющий синдром приводит к необратимым метаболическим нарушениям, обезвоживанию.
При классических формах расстройства степень вирилизации различается: от гирсутизма до яркого гетеросексуализма. Первые симптомы отклонений у младенцев женского пола обнаруживаются сразу после рождения. Вирильная форма у мальчиков проявляется позднее. Примечательно, что при рождении их половые органы правильно сформированы. Клинически синдром проявляется в 3–4 года. По мере взросления у мальчиков с гиперплазией надпочечников прогрессирует репродуктивная дисфункция.
Благоприятной в плане течения считаются неклассические формы адреногенитальных отклонений. Признаки скрытого синдрома проявляются во время полового созревания. При этом гениталии больных имеют вполне нормальное строение, расстройство выявляется случайно во время обследования по поводу бесплодия или нарушения менструального цикла. В зависимости от дефекта ферментных систем выделяют следующие виды адреногенитального синдрома:
|
Дефектный фермент |
Клиническая картина |
|
20, 22-десмолаза |
Нарушается секреция стероидов из холестерина в активные стероиды, что приводит к сольтеряющему синдрому, глюкокортикоидной недостаточности и летальному исходу. |
|
3-ол-дегидрогеназа |
Приводит к нарушению выработки кортизола и альдостерона, на фоне чего развивается синдром потери соли. За счет частичной выработки дегидроэпиандростерона вирилизация у девочек имеет слабовыраженный характер. |
|
17-гидроксилаза |
Проявляется дефицитом эстрогенов, андрогенов, кортизола. Провоцирует половое недоразвитие, гипертонию, гипокалиемический алкалоз. |
|
11-гидроксилаза |
Вызывает существенный избыток 1-дезоксикортикостерона. При этом варианте синдрома признаки вирилизации менее выражены. Отмечается высокое давление, задержка хлоридов, натрия. |
|
18-оксидаза |
Приводит к недостатку альдостерона. Клинически адреногенитальное расстройство проявляется сольтеряющим синдромом. Приводит к смерти в раннем детстве. |
|
21-гидроксилаза |
Тяжесть клиники синдрома обусловлена степенью блокировки ферментных систем. При полном нарушении процессов гидроксилирования наступает смерть. Частичная блокировка вызывает гиперпродукцию 17 -гидроксипрогестерона, прегнантриола, стероидов с андрогенными свойствами, что вызывает вирилизацию и нарушение водно-солевого баланса. |
Механизм развития
Генетический дефект передается по аутосомно-рецессивному типу. Синдром главным образом возникает вследствие недостаточной выработки 21-гидроксилазы.
В остальных случаях дефект ДНК приводит к нарушению производства других ферментов, участвующих в стероидогенезе – 3-β-гидроксистероиддегидрогеназы, 22-десмолазы, синтетазы альдостерона и др
Важно понимать, причины отклонений носят сугубо наследственный характер. Факторами риска синдрома принято считать:
- повышенный уровень ионизирующего излучения;
- прием сильнодействующих препаратов;
- острое либо хроническое радиационное отравление;
- интеркуррентные патологии;
- длительное использование гормональных контрацептивов;
- хирургическое вмешательство;
- дисфункция щитовидной железы;
- аборты;
- патологии почек;
- опухолевый процесс;
- травмы;
- стрессы.
В основе механизма развития классического (врожденного) варианта адреногенитальных нарушений лежит принцип обратной связи, начальным звеном которой является недостаток стероидов. Несостоятельность процесса гидроксилирования сопровождается неполным превращением прогестерона, а также 17-гидроксипрогестерона в дезоксикортикостерон и 11-дезоксикортизол. В результате уровень кортизола снижается. При этом усиливается выработка адренокортикотропного гормона (АКТГ), который, собственно, и вызывает компенсаторную гиперплазию коры надпочечников.
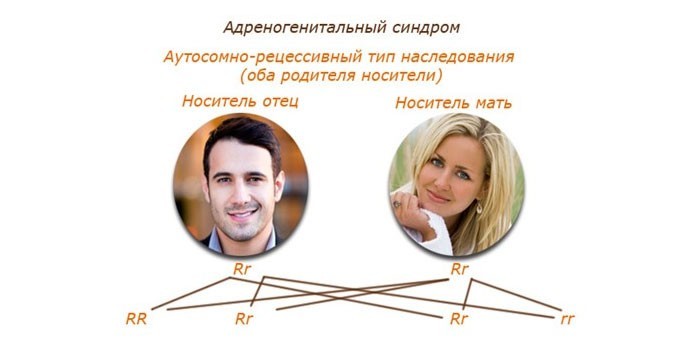
Риск наследования патологии
Вероятность рождения ребенка с адреногенитальным расстройством при носительстве патологического гена у обоих родителей составляет 25%, а в браке носителя и больного – 75%. При ситуации, когда один партнер имеет полноценное ДНК, клинические проявления синдрома у детей не обнаруживаются. Крайне редко адреногенитальные нарушения наследуются спорадически. Внезапное появление признаков синдрома, как правило, обусловлено нарушениями в процессе формирования женских и мужских репродуктивных клеток.
Профилактика
Мер специфической профилактики для предотвращения адреногенитального синдрома не существует. Это связано с причиной его возникновения.
Для того, чтобы предупредить рождение ребёнка с данным заболеванием следует на этапе зачатия проконсультироваться с генетиком и определить степень риска в возникновении синдрома
Это особенно важно если будущие родители или близкие родственники имеют подобную патологию
При развивающейся беременности, родителям, в семье которых встречаются случаи данной патологии следует провести кариотипирование плода, с целью проверки генотипа на наличие дефектов и соблюдать все рекомендации по ведению беременности.
Скрининг и другие методы диагностики
При обследовании беременных о возможности гиперплазии надпочечников может свидетельствовать аномальное формирование половых органов плода. Это можно увидеть на втором скрининговом акушерском УЗИ. В таких случаях рекомендуется дополнительное обследование для выявления патологии еще до родов. Проводят анализ амниотической жидкости или после 21 недели берут кровь плода (из пуповины под контролем УЗИ).
После родов назначается обследование:
- проба с АКТГ – нет повышения содержания кортизола после его введения;
- анализ крови – снижен натрий, повышен калий, 17 ОН-прогестерон в 5-7 раз и более, андростендион (предшественник стероидов), ренин (при сольтеряющей форме);
- анализ мочи – высокая концентрация 17-кетостероидов, после приема преднизолона снижается наполовину.
 Анализ амниотической жидкости
Анализ амниотической жидкости
Для молодых женщин с нетипичным течением гиперплазии учитывают данные, полученные при:
- рентгенографии костей кисти (раннее завершение роста);
- УЗИ яичников – фолликулы, не достигающие овуляции;
- измерении температуры в прямой кишке на протяжении цикла (базальной) – отсутствие изменений, характерных для овуляции.
Причины
Надпочечники — это парные эндокринные железы, лежащие в непосредственной близости от верхнего полюса почек. Они очень маленькие: длина составляет всего 6 см, а ширина 3 — 4 см, тем не менее, значение их деятельности весьма значительно. Каждый надпочечник состоит из коркового и мозгового вещества.
Кора надпочечников вырабатывает следующие гормоны:
- Глюкокортикоиды (гидрокортизон, кортизон, кортикостерон). Глюкокортикоиды влияют на углеводный и белковый обмен, воздействуют на иммунный ответ, подавляют аллергические и воспалительные реакции, замедляют рост костной и хрящевой ткани.
- Минералокортикоиды (альдостерон) участвуют в поддержании баланса натрия и калия в организме.
- Половые гормоны (андрогены и эстрогены), которые контролируют развитие вторичных половых признаков.
- Мозговое вещество надпочечников вырабатывает адреналин и норадреналин. Адреналин усиливает и учащает сокращение сердца, повышает возбудимость сердечной мышцы, расширяет сосуды сердца и мозга, сосуды работающих мышц, суживает сосуды брюшных органов и кожи (кроме кожи лица), вызывая адреногенитальный синдром у новорожденных. Он усиливает расщепление гликогена в печени и в мышцах до глюкозы и дальнейшее его окисление с выделением энергии. Таким образом, адреналин может вызвать экстренное изменение состояния организма, направленное на повышение работоспособности. Норадреналин вызывает сужение всех кровеносных сосудов, по остальному действию на организм он сходен с адреналином.
При недостаточности коры надпочечников начинает вырабатываться избыточное количество адренокортикотропного гормона — гормона гипофиза, который регулирует деятельность надпочечников. Под влиянием адренокортикотропного гормона резко возрастает выработка надпочечниковых андрогенов, оказывающих маскулинизирующее действие (появление и усиление признаков мужского пола) уже во внутриутробном периоде. Последствия гормональных нарушений бывают различными — от легкой маскулинизации до грубых анатомических аномалий соматического и полового развития.
Механизм развития
Генетическая аномалия нарушает образование гормонов надпочечников. На это реагирует гипофиз выработкой адренокортикотропного гормона (АКТГ). Это соединение в норме стимулирует синтез стероидов. Результатом активации является увеличение надпочечных желез.
Даже большие надпочечники не способны образовывать кортизол и альдостерон, так как имеется разрыв ферментативной цепи. Возникает такое состояние, как врожденная гиперплазия надпочечников. Именно так эндокринологи формулируют диагноз адреногенитального синдрома.
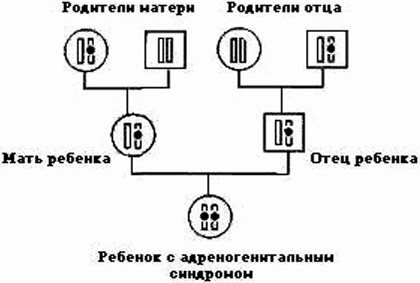
Путь наследования врожденной гиперплазии надпочечников. Патологический ген обозначен черным кружочком
Если стероидные гормоны не могут образоваться, то производство мужских половых гормонов (андрогенов) при гиперплазии возрастает. Все предшественники кортизола и альдостерона используются надпочечниками для синтеза андрогенов.
Мужские гормоны в организме женщин вырабатывают только надпочечники. Их избыток вызывает маскулинизацию, то есть приобретение половых признаков мужчины. Это проявляется очень ярко еще и потому, что андрогены имеют свойство подавлять действие женских (эстрогенов).
У мальчиков основная часть андрогенов продуцируется яичками, но так как надпочечниковые гормоны имеются в крови в избытке, то собственные железы теряют активность. Яички атрофируются. Повышенное содержание гормонов стимулирует раннее половое созревание и отставание в росте, так как удлинение костей скелета прекращается с наступлением половой зрелости.
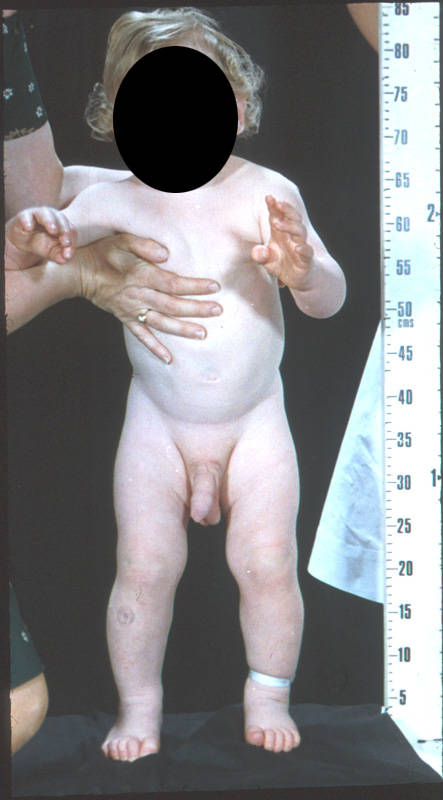
Раннее половое созревание мальчика