Апластическая анемия: какую несет в себе угрозу
Содержание:
- Классификация апластических анемий
- Лечение
- Какое обследование проводят для диагностики
- Процессы развития
- Патогенез заболевания
- Картина крови и степени тяжести
- Какое обследование проводят для диагностики
- Диагностика апластической анемии
- Апластическая анемия прогноз
- Лечение
- Симптомы апластической анемии у ребенка
- И еще пару слов о прогнозе…
- Апластическая анемия – причины
Классификация апластических анемий
Болезнь, описанная еще в конце 19 века, не хочет сбавлять обороты, ведь стремительное движение человечества к новым познаниям и изобретениям подталкивает людей к очень тесному контакту с факторами, способными привести к аномальному состоянию стволовой клетки. В итоге – частота заболеваемости только растет, смертность от данной патологии хоть и падает, благодаря развитию трансплантологии и лечению новейшими иммуносупрессивными препаратами, но не в той мере, как хотелось бы.

В настоящее время выделено два типа АА, содержащие по несколько видов, каждый из которых имеет свои подвиды, исходя из причин и клинических проявлений. Следует отметить, что классификация в разных источниках, хоть и не существенно, но отличается, к тому же классификация, используемая для установления диагноза и лечения взрослых, не совсем подходит для детского и подросткового периода (например, у детей часто встречается такая форма, как транзиторная АА – о ней также будет упомянуто ниже).
Итак, выделяют:
а) Приобретенные формы:
-
Истинная АА, которая ≈ в 50% случаев представлена идиопатической апластической анемией (для нее характерно подавление всех линий кроветворения без видимых причин), имеет три формы течения:
- острую, которая продолжается до 2 месяцев и заканчивается 100-процентной гибелью больных;
- подострую (гипо- и апластическая анемия с кратковременной стабилизацией при АА и с чередованием ремиссий и обострений при ГА, длительность болезни от 2 месяцев и дольше);
- хроническую гипо- и апластическую анемию, имеющую относительно спокойное течение, страдания костного мозга и организма больного продолжаются от года до 3 – 5 лет, иногда процесс затягивается до 10 лет и более и в отдельных случаях приводит к выздоровлению.
- Парциальная красноклеточная аплазия костного мозга (ПККА) – анемия аутоиммунного характера, обусловленная воздействием аутоантител на антигены эритрокариоцитов КМ, в результате чего сильно угнетается продукция красных клеток крови. Наиболее часто встречаемая форма – идиопатическая, иногда развитие ПККА обусловлено формированием опухоли вилочковой железы (тимомы). Отдельные авторы напоминают о существовании еще одного вида такой анемии, которая проявляется у детей старшего возраста – подростковой ПККА, имеющей благоприятное течение;
- Гипопластическая анемия с гемолитическим компонентом – в отношении этой формы существуют постоянные разногласия, поскольку отдельные авторы утверждают, что данная патология выступает в качестве определенной стадии пароксизмальной ночной гемоглобинурии. Хроническая гипопластическая анемия с гемолитическим компонентом при рецидивах болезни сопровождается гемолитическими кризами, что является ее особенностью.
б) Врожденные и наследственные формы:
- Конституциальная анемия Фанкони (аутосомно-рецессивный тип наследования, проявляется у гомозигот в возрасте 4-10 лет), представлена двумя типами: 1) анемия с грубыми аномалиями развития органов, 2) анемия с малыми (незначительными) дефектами развития;
- Анемия Джозефа-Даймонда-Блекфена (красноклеточная аплазия КМ, тип наследования – не выяснен, предположительно – аутосомно-доминантный, но другие утверждают, что аутосомно-рецессивный), болезнь проявляет себя очень рано, уже к 4 месяцам у 2/3 детей дебютируют первые признаки, у остальной трети они появятся к году. Анемия Даймонда-Блекфена имеет две разновидности: 1) анемия с аномалиями развития органов, 2) анемия без аномалий;
- Семейная гипопластическая анемия Эстрена-Дамешека (семейная гипопластическая анемия у детей, которая характеризуется общим поражением кроветворения при отсутствии дефектов развития).
Поскольку гипопластическая анемия в случае врожденных форм выступает, как один из симптомов основной патологии, к тому же, болезнь становится видимой с раннего детства, нет смысла останавливаться на ней в данной работе. Читателей, скорее всего, больше волнует та форма, которая в течение жизни может настигнуть любого человека, даже если он родился вполне себе здоровым.
Лечение
Чтобы справиться с заболеванием крови, нужно устранить причину возникновения. Вылечить анемию сложно. Выполнить назначения можно только при госпитализации. Изоляция больного поможет избежать инфекций. Главные направления лечения:
- Восстановление выработки элементов крови с помощью лекарств.
- Пересадка костного мозга.
- Переливание и очистка крови при тяжелых формах болезни.
- Устранение инфекций.
Лекарства
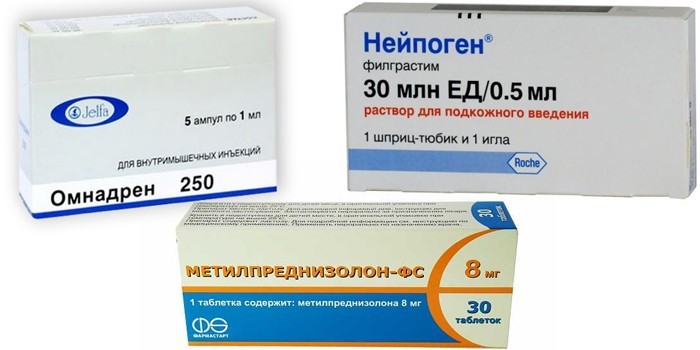
Если гипопластическая анемия вызвана клетками иммунитета, которые приняли клетки организма за чужой агент, лечение начинают с иммуносупрессивной терапии.
До начала и во время терапии контролируют количество всех элементов крови.
Порядок действий:
- При любой форме для подавления иммунитета используют глюкокортикоид Метилпреднизолон.
- Восстановить процессы кроветворения помогает стимулятор роста клеток Нейпоген. С этой же целью назначают Омнадрен 250 – анаболический стероид.
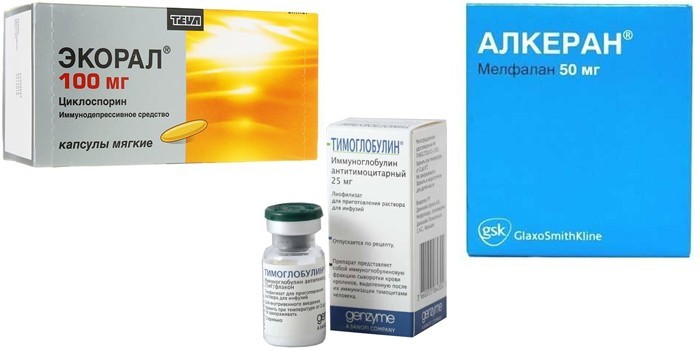
При тяжелом течении анемии пациенту назначают такие лекарства:
- Экорал – он уменьшает агрессию собственного иммунитета.
- Тимоглобулин – для снижения числа лимфоцитов.
- Алкеран – противоопухолевый цитостатик (нарушающий рост, развитие клеток), применяется в виде инъекций.
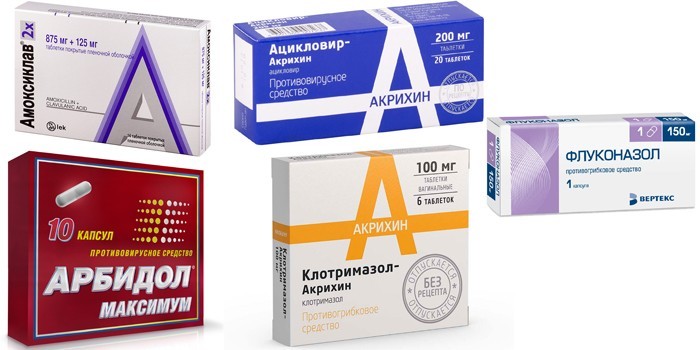
Если анемию сопровождают инфекции, назначают такие лекарства:
- антибиотики Амоксиклав, Цефалоспорин;
- противовирусные Арбидол, Ацикловир,
- противогрибковые Клотримазол, Флуконазол.
Гемотрансфузии
Состояние больного апластической анемией будет лучше, если сделать переливание крови донора. Это насытит ткани кислородом, устранит симптомы заболевания. Для процедуры используют массу с большим количеством тромбоцитов или эритроцитов. Особенности процесса:
- идет замещение крови с низким числом клеток;
- устраняется дефицит тромбоцитов или эритроцитов;
- минус – возможно отторжение чужих клеток.
Другой вариант борьбы с апластической анемией – плазмаферез. Его применяют при тяжелой форме болезни для очистки от агрессивных агентов иммунитета либо при неэффективности переливания (гемотрансфузии). Порядок процедуры очищения крови:
- Пациенту в вену ставят катетер.
- Делают забор крови.
- Ее пропускают через устройство, где разделяют на отдельные элементы.
- Каждый из них проходит очистку.
- Через катетер на другой руке кровь поступает обратно.

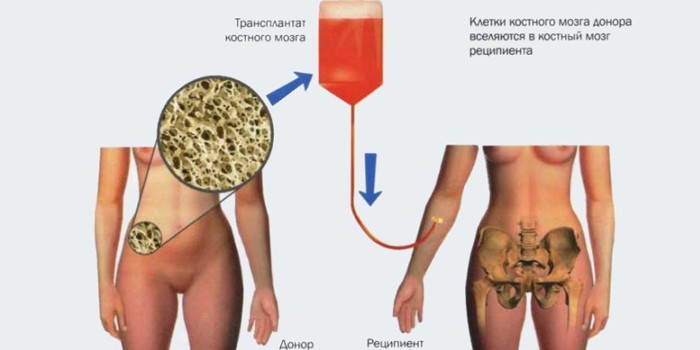
Трансплантация
Самые тяжелые случаи гипопластической анемии лечат пересадкой костного мозга. Это увеличивает продолжительность жизни больного. Важные условия трансплантации:
- Костный мозг донора и пациента совпадают по ряду параметров.
- Забор биоматериала производят под общей анестезией.
- За несколько проколов набирают около литра костного мозга.
- Больному анемией его вливают через вену.
При пересадке стволовых клеток донорами становятся близкие родственники. Благодаря этому методу костный мозг пациента оздоравливается. Операция включает следующие действия:
- Подбирают донора.
- На костный мозг больного воздействуют радиацией.
- Стволовые клетки выделяют из костного мозга донора и вводят пациенту.
Есть вариант борьбы с апластической анемией с полной совместимостью биоматериала. Для этого используют собственные стволовые клетки человека.
Сейчас во время родов делают забор крови из плаценты и пуповины новорожденного. Биоматериал консервируют. При необходимости его достают из хранилища и используют для излечения болезней.
Молодые и здоровые элементы крови справляются с тяжелыми патологиями.
Какое обследование проводят для диагностики
В схему обследования необходимо включить проведение следующих исследований:
- общий анализ крови с подсчетом ретикулоцитов, тромбоцитов, определением гематокрита;
- группа крови и резус-фактор пациента для подготовки к переливанию крови;
- исследование пунктата из костного мозга, а при подозрении на врожденные формы — костей черепа;
- иммунологические анализы на антитела к клеткам крови, определение количества иммуноглобулинов, проведение реакции бласттрансформации лимфоцитов;
- биохимические тесты: билирубин и его формы; общий белок с протеинограммой; «печеночные пробы» АЛТ, ACT; содержание сывороточного железа;
- проведение рентгенографического исследования костей черепа, грудной клетки, кистей рук;
- УЗИ органов брюшной полости позволит определить размеры печени и селезенки.
При подозрении на врожденное заболевание потребуется обследование близких родственников.
При наличии инфекционных проявления нужна консультация стоматолога, отоларинголога, хирурга.
Процессы развития
Современной медицине пока окончательно не известны механизмы и причины, которые приводят к формированию недоразвития костного мозга.
Выделяют несколько процессов развития апластической анемии:
- Развитие в организме процессов, приводящих к поражению стволовых клеток костного мозга.
- Действие защитных механизмов организма (клеточных, под влияние гормонов), в результате которого процессы образования клеток крови подавляются.
- Различные виды нарушений функционирования элементов микроокружения костного мозга (остеогенные, жировые клетки, макрофаги и другие).
- Недостаток в организме факторов, которые активизируют процессы кроветворения.
- Случаи, когда концентрация необходимых для кроветворения веществ сохраняется на должном уровне (в частности, железо в крови, витамин В12, протопорфирин), но они не усваиваются кроветворной тканью.
Заболевание анемии сопровождается нарушениями процессов выведения излишков железа, которое кумулируется в печени и селезенке.
Из-за понижения лейкоцитов в крови происходят сбои в работе иммунной системе организма. Снижением концентрации тромбоцитов в крови объясняется нарушение процессов свертываемости крови.
Повышение лимфоцитов, Отмечается «опустошение» костного мозга (панмиелофтиз).
Поскольку в крови снижается количество зрелых эритроцитов, это приводит к развитию хронической гипоксии в тканях, что влечет за собой дистрофические изменения внутренних органов. В первую очередь очень чувствительны к гипоксии (кислородное голодание) эндокринные железы.
Патогенез заболевания
Апластическая анемия вызвана подавлением процесса производства кровяных телец в костном мозге. Возможен повышенный уровень разрушения и уничтожения клеток собственными антигенами. Изучается механизм апоптоза (самопроизвольного уничтожающего процесса эритроцитов). Его приравнивают к «запрограммированному суициду». Установлена повышенная активность ферментов деструктивного действия в крови, дефицит нуклеиновых кислот.
Разрушение эритроцитов наблюдается внутри костного мозга на всех уровнях созревания. Снижается продолжительность жизни красных кровяных клеток.
Поскольку утилизация железа нарушается, излишки откладываются в печени и селезенке.
Образуется повышение уровня гормона эритропоэтина, но костный мозг не реагирует на его приказы.
Со снижением гранулоцитов блокируется их функция по участию в иммунной защите организма. Соответственное проявление сниженной свертываемости происходит из-за тромбоцитопенического синдрома.
Количество лимфоцитов увеличено. Костный мозг становится «пустым» (панмиелофтиз).
Картина крови и степени тяжести
В периферической крови, взятой из пальца, обнаруживают:
- снижение эритроцитов, изменение их формы и размеров;
- низкий уровень гемоглобина;
- снижение относительного и абсолютного количества тромбоцитов и гранулоцитов;
- ускоренную СОЭ;
- относительный лимфоцитоз;
- рост числа ретикулоцитов.
Умеренно тяжелой формой анемии считается болезнь с содержанием нейтрофилов от 0,2 до 0,5 х 10 9 в литре крови.
К тяжелым случаям относят случаи при количестве гранулоцитов мене 0,5 х 10 9 , тромбоцитов — менее 10 х 10 9 , ретикулоцитов — до 1%; при этом в костномозговом пунктате должно быть клеток, не образующих кровяные элементы, более 65%, а предшественников эритроцитарного ростка — единицы.
Крайне тяжелой называют стадию болезни, если нейтрофилов менее 0,2 х 10 9 .
Какое обследование проводят для диагностики
В схему обследования необходимо включить проведение следующих исследований:
- общий анализ крови с подсчетом ретикулоцитов, тромбоцитов, определением гематокрита;
- группа крови и резус-фактор пациента для подготовки к переливанию крови;
- исследование пунктата из костного мозга, а при подозрении на врожденные формы — костей черепа;
- иммунологические анализы на антитела к клеткам крови, определение количества иммуноглобулинов, проведение реакции бласттрансформации лимфоцитов;
- биохимические тесты: билирубин и его формы; общий белок с протеинограммой; «печеночные пробы» АЛТ, ACT; содержание сывороточного железа;
- проведение рентгенографического исследования костей черепа, грудной клетки, кистей рук;
- УЗИ органов брюшной полости позволит определить размеры печени и селезенки.
При подозрении на врожденное заболевание потребуется обследование близких родственников.
При наличии инфекционных проявления нужна консультация стоматолога, отоларинголога, хирурга.
Диагностика апластической анемии
Наиболее ценными дополнительными исследованиями являются:
- общий анализ крови (ОАК);
- биохимический анализ крови (БАК);
- стернальная пункция;
- трепанобиопсия.
Общий анализ крови
снижение количества всех трех типов клеток костного мозганейтрофилы, эозинофилы и базофилыОриентировочными показателями ОАК при апластической анемии являются:
- Гемоглобин (Hb) – менее 110 г\л (норма 120 – 160 г\л). Уменьшение за счет снижения числа эритроцитов.
- Эритроциты – 0,7 – 2,5 х 1012\л (норма 3,7 х 1012\л). Снижение количества зрелых эритроцитов.
- Ретикулоциты — менее 0,2% (норма 0,3 – 2,0%). Снижение количества молодых форм эритроцитов.
- Цветовой показатель – 0,85 – 1,05 (норма 0,85 – 1,05) свидетельствует о нормохромном характере анемии (содержание гемоглобина в эритроците в пределах нормы).
- Гематокрит (Ht) – менее 30 (норма 35 – 42 у женщин и 40 – 46 у мужчин). Соотношение клеточного состава крови к ее жидкой части. Наблюдается явное уменьшение доли клеток в периферической крови.
- Тромбоциты – менее 35 промилле или 100 х 109\л. Снижение количества тромбоцитов.
- Лейкоциты – 0,5 – 2,5 х 109\л (норма 4 – 9 х 109\л). Выраженная лейкопения за счет снижения числа гранулоцитов (нейтрофилы, эозинофилы и базофилы).
- Палочкоядерные нейтрофилы – 0 – 2% (норма менее 6%). Снижение выработки молодых форм лейкоцитов.
- Сегментоядерные нейтрофилы – 0 – 40% (норма 47 – 72%). Снижение количества зрелых форм нейтрофилов.
- Миелоциты – 0 – 2% (в норме отсутствуют). В условиях гранулоцитопении и наслоения бактериальной инфекции наблюдается более выраженный, чем обычно, сдвиг лейкоцитарной формулы влево с появлением клеток предшественников лейкопоэза.
- Эозинофилы – 0 – 1% (норма 1 – 5%). Снижение количества эозинофилов.
- Базофилы – 0% (норма 0 – 1%). Единичные или полное отсутствие базофилов.
- Лимфоциты – более 40% (норма 19 – 37%). Численное количество лимфоцитов остается в норме. За счет снижения фракции гранулоцитов наблюдается относительный лимфоцитоз (увеличение доли лимфоцитов в крови). Крайне выраженный лимфоцитоз может наблюдаться при наслоении вирусных инфекций.
- Моноциты – более 8% (норма 6 – 8%). Количество моноцитов неизменно и находится в пределах нормы. Моноцитоз (увеличение доли моноцитов в крови) объясняется снижением процентной доли гранулоцитов в лейкоцитарной формуле.
- Скорость оседания эритроцитов – более 15 – 20 мм\час (норма до 10 мм/час у мужчин и до 15 мм/час у женщин). Данный показатель отражает степень выраженности воспалительной реакции в организме.
- Анизоцитоз – наличие в крови эритроцитов различного размера.
- Пойкилоцитоз – наличие в крови эритроцитов различной формы.
Биохимический анализ крови
Ориентировочными показателями БАК при апластической анемии являются:
- Сывороточное железо более 30 мкмоль\л (норма 9 – 30 мкмоль/л). Увеличение сывороточного железа на фоне частых переливаний крови. Высокий риск развития гемохроматоза.
- Эритропоэтин более 30 МЕ\л (норма 8 – 30 МЕ/л у женщин и 9 – 28 МЕ\л у мужчин). Увеличение эритропоэтина происходит по двум причинам. Во-первых, не происходит его потребления клетками эритроцитарного ростка. Во-вторых, компенсаторно усиливается его синтез в ответ на анемию.
- НBs-АГ и анти HBcor иммуноглобулины G – положительны (в норме — отрицательны). Данный анализ указывает на наличие вирусного гепатита В. В ряде случаев данный вирус провоцирует развитие аутоиммунной реакции против клеток костного мозга.
- С-реактивный белок – более 10 – 15 мг\л (норма 0 – 5 мг\л). Выявляется при воспалительной реакции на фоне ослабленного иммунитета.
- Тимоловая проба – более 4 (норма 0 — 4). Выявляет признаки воспаления при ослабленном иммунитете.
Трепанобиопсия
миелограммыАпластическая анемия средней тяжести определяется следующими показателями:
- гранулоциты менее 2,0 х 109\л;
- тромбоциты менее 100 х 109\л;
- ретикулоциты менее 2 – 3%;
- гипоплазия костного мозга на трепанобиопсии.
Апластическая анемия тяжелой степени определяется следующими показателями:
- гранулоциты менее 0,5 х 109\л;
- тромбоциты менее 20 х 109\л;
- ретикулоциты менее 1%;
- аплазия костного мозга на трепанобиопсии.
Апластическая анемия крайне тяжелой степени определяется следующими показателями:
- гранулоциты менее 0,2 х 109\л;
- тромбоциты единичные или отсутствуют;
- ретикулоциты единичные или отсутствуют;
- аплазия костного мозга на трепанобиопсии.
Апластическая анемия прогноз
Прогноз для жизни, трудоспособности и состояния здоровья пациентов с признаками апластической анемии напрямую зависит от степени тяжести заболевания и глубины снижения уровня жизненно важных клеток кроветворения.
К сожалению, по сей день, мировая статистика показывает неутешительные данные в отношении показателя смертности от апластической анемии, независимо от того, насколько прогрессивно развивается фармацевтическая отрасль в отношении лечения болезней крови. Высокая смертность наблюдается среди пациентов с тяжелой формой панцитопении и в большей степени причиной смерти является генерализованная форма сепсиса, как конечная стадия лейкоцитопении.
Значительно улучшились прогнозы после начала применения радикальных методов лечения (трансплантация стволовых клеток костного мозга, использование иммунодепрессантов). В 50-90% случаев применение этих способов лечения можно добиться полного выздоровления пациента.
Применение Антитимоцитарного и Антилимфоцитарного иммуноглобулинов в сочетании с терапией Циклоспорином позволяют лишь в 60-70% случаев добиться ремиссии заболевания.
Лечение
Лечение апластической анемии зависит от главного фактора, который предположительно стал причиной развития патологического процесса.
Если заболевание выявлено впервые, больной обязательно подлежит госпитализации в стационар, отделение гематологии. Только в условиях лечебного учреждения можно корректно подобрать необходимый для лечения лекарственный препарат, а также определиться с его дозировкой.
Основными методиками коррекции и лечения апластической анемии у детей и взрослого являются:
- трансфузионные методы (переливание крови);
- трансплантационные методы;
- медикаментозные методы.
Трансфузия
Трансфузионный терапевтический метод предполагает переливание больному цельной, эритроцитарной или тромбоцитарной массы, а также гранулоцитов крови. Препараты крови, использующие в трансфузии, готовятся на станциях переливания из донорской крови. Данный метод трансфузии — временный, так как он позволяет только восполнить дефицит клеток крови, но нарушения в костном мозге при этом не ликвидируются. Еще одним минусом трансфузии является то, что при диагностировании аутоиммунных форм апластической анемии применять его нельзя.

Если операции по переливанию крови больному делают довольно часто, это может привести к накоплению в его организме излишков железа, которые откладываются в печени и селезенке. Поэтому такой категории пациентов включают в терапию лекарственные препараты, влияющие на выведение железа из крови.
Трансплантация
Наиболее эффективным методом лечения апластической анемии принято считать трансплантационный, при котором происходит пересадка костного мозга человека. Вероятность успеха операции по пересадке костного мозга зависит от возраста больного, процент успешного исхода тем выше, чем моложе пациент. В качестве донора может выступить один из ближайших родственников, имеющий такую же группу крови, что и больной. Для этого необходимо провести исследование на индивидуальную совместимость их групп крови.
Данная методика лечения требует определенной подготовки, чтобы снизить процент вероятности отторжения чужеродных тканей. Перед процедурой переливания крови отменяются, назначается проведение лучевой терапии, закрепленной в последствие курсом химиотерапевтических препаратов. Делается это с целью временного подавления иммунной системы больного, которая может спровоцировать отторжение донорских стволовых клеток. Трансплантация костного мозга при анемии – очень дорогостоящая операция, проводится только в специализированных клиниках.
Медикаменты
Медикаментозная терапия при апластической анемии у человека включает применение следующих лекарственных средств:
- иммунодепрессанты – например, циклоспорин, специфические антиглобулины. Применение этих лекарственных форм показано в тех случаях, когда невозможно провести операцию по пересадке костного мозга. Назначаются они комплексно с кортикостероидами, чтобы предупредить развитие анафилактических реакций;
- лекарственные препараты, стимулирующие процессы кроветворения – например, филграстим, лейкомакс. Назначают их только в случае диагностирования лейкопении, поскольку они активируют процессы образования гранулярных лейкоцитов;
- для лечения апластической анемии у мужчин применяют препараты, содержащие андрогены (мужские половые гормоны) – тестостерона пропионат, сустанон;
- при выраженном геморрагическом синдроме показано назначение гемостатиков – дицинон, аминокапроновая кислота;
- одним из примеров препаратов, способствующих выведению железа из крови, является десферал.
Спленэктомия
Еще один метод лечения апластических анемий — спленэктомия, другими словами операция по удалению селезенки. Частота положительного эффекта составляет 85%. В основе этого метода лечения лежит прекращение аутоиммунных процессов в организме, когда вырабатываются антитела к собственным клеткам. Его можно проводить любым пациентам, у которых отсутствуют инфекционные осложнения.
Симптомы апластической анемии у ребенка
Все симптомы апластических анемий объединены в 3 синдрома (устойчивая совокупность симптомов, объединенных единым развитием).
-
Анемический синдром (то есть связанный со снижением уровня гемоглобина – особого вещества эритроцитов (красных клеток крови), переносящего кислород)
- слабость, снижение работоспособности;
- головокружение;
- обморочные состояния;
- шум в ушах;
- мелькание « мушек» перед глазами;
- одышка (учащенное дыхание) и сердцебиение при незначительной физической нагрузке;
- колющие боли в грудной клетке.
-
Геморрагический синдром (то есть повышенная кровоточивость) развивается при снижении количества тромбоцитов (кровяных пластинок, склеивание которых обеспечивает образование тромба – сгустка крови) и при их неполноценности. Проявления:
- кровоизлияния на коже и слизистых оболочках;
- носовые кровотечения;
- кровотечения из десен;
- маточные кровотечения (у девушек);
- почечные и другие кровотечения;
- кровоизлияния в головной мозг (редко).
-
Синдром инфекционных осложнений развивается при снижении количества лейкоцитов (белых клеток крови, выполняющих защитные функции):
- инфекции кожи;
- инфекции дыхательных путей;
- инфекции мочевыводящих путей и др.
Также симптомами этого заболевания могут являться следующие признаки:
- замедляется рост ребенка;
- нарушается гармоничное развитие ребенка (некоторые из показателей – рост, вес, развитие речи – соответствуют возрастной норме, а некоторые – отстают);
- часто возникают инфекционные заболевания;
- имеющиеся хронические заболевания протекают тяжелее.
И еще пару слов о прогнозе…
Хоть прогноза апластической анемии вскользь и касались в ходе описания болезни, но хотелось бы добавить еще несколько слов.
Главной причиной смерти больных при АА являются инфекции и кровотечения. Некоторые авторы считают, что весьма нехорошими прогностическими признаками являются: прием левомицетина (пусть и короткими курсами) и развитие болезни после инфекционного гепатита (тяжелая костномозговая аплазия рассматривается, как показание к пересадке КМ в самом начале болезни).
Однако не стоит сразу отчаиваться и воспринимать АА как смертельный приговор. Использование современных методов лечения, в целом, улучшает ситуацию и позволяют многим пациентам заметно увеличить продолжительность жизни, а то и вообще избавиться от тяжелого заболевания.
А вообще, прогноз строится в первую очередь, исходя из формы заболевания. Например, идиопатическая АА, если она не протекает в острой сверхтяжелой форме, дает больше надежд на многолетнюю выживаемость или выздоровление
Но прогнозировать что-то наперед может только лечащий врач (да и то с большой осторожностью), наша задача лишь дать общие сведения о таком патологическом состоянии, как апластическая анемия
2012-2020 sosudinfo.ru
Вывести все публикации с меткой:
Анемия
Перейти в раздел:
Кровь и её заболевания, компоненты, анализы, биохимия
Рекомендации читателям СосудИнфо дают профессиональные медики с высшим образованием и опытом профильной работы.
На ваш вопрос в форму ниже ответит один из ведущих авторов сайта.
Апластическая анемия – причины
Выделить единственную причину невозможно, так как вызвать апластическую анемию могут различные факторы. Они разительно отличаются друг от друга, но могут приводить к одинаково тяжелым последствиям.
Справочно. Выделяют два основных типа заболевания – врожденный и приобретенный. В первом случае ребенок первоначально содержит генную мутацию, которая приводит к нарушению кроветворной функции. Во втором варианте нарушение выработки клеток крови происходят под влиянием внутренних (эндогенных) или внешних (экзогенных) факторов.
Клиническая картина этих вариантов отличается. Во-первых, врожденные формы часто проявляются на ранних сроках жизни. Во-вторых, они могут сочетаться с аномалиями развития различных органов.
Внимание. В зависимости от вида хромосомной мутации, может наблюдаться снижение производства лишь одного вида кровяных клеток
При манифестации во взрослом возрасте первыми симптомами могут быть общее недомогание и головокружение, которые являются неспецифичным и возникают при многих заболеваниях. Скорость прогрессирования апластической анемии зависит от выраженности нарушения кроветворной функции.
Апластическая анемия у детей (врожденная)
Врожденные формы включают в себя следующие варианты:
- Синдром Даймонда-Блекфена. При данной патологии происходит нарушение на уровне клеток-предшественников эритроцитов. Фенотипическим симптомом является бледная кожа. Увеличение печени и селезенки не характерно, но может развиваться с течением времени.
- Анемия Фанкони. Наследственное заболевание, которое проявляется на пятом десятке жизни. Возникает острый лейкоз и апластическая анемия. Для данной генной мутации характерны аномалии развития, которые проявляются уже на ранних сроках жизни. В основном это аномалии костной системы (низкий рост, маленький череп, недоразвитие первого пальца верхних конечностей, лучевой кости, тяжелая дисплазия бедра, дополнительное ребро) и неврологический дефицит (аномалии глазных яблок, косоглазие, птоз, нарушение слуха, умственные нарушения развития).
- Синдром Эстрена-Дамешека. Помимо нарушения кроветворения для данных детей характерна определенная внешность – светлые волосы, широко расставленные глаза, курносый нос. Апластическую анемию в этом варианте сопровождает увеличение печени и селезенки.
Приобретенная апластическая анемия
Приобретенные формы различают по факторам, которые вызывают апластическую анемию.
- Внешние (экзогенные) факторы:
- Медикаментозное влияние – прием сульфаниламидов, антибактериальных средств (тетрациклин, левомицитин, стрептомицин), средств для лечения туберкулеза (изониазид, ПАСК), анальгина, цитостатиков.
- Воздействие химических агентов – наиболее опасны нефтепродукты, бензольные производные, ртуть.
- Радиоактивное воздействие.
- Инфекции. Наиболее опасными являются вирус, вызывающий гепатит С, цитомегаловирус, герпес-вирус. Чаще всего они оказывают выраженное повреждающее действие лишь при активно перенесенном заболевании.
- Внутренние (эндогенные) факторы:
- Аутоиммунное поражение костного мозга. Чаще наблюдается в пожилом возрасте.
- Эндокринное влияние. Выявлена связь с нарушением функции щитовидной железы, и с заболеваниями яичников у женщин.
Внимание. Данное разделение условное, так как даже экзогенные факторы могут влиять на костный мозг опосредованно через запуск аутоиммунной агрессии