Африканский трипаносомоз (сонная болезнь): причины, симптомы, диагностика, лечение
Содержание:
Признаки и симптомы
Клиническое заболевание имеет 2 стадии. Для них характерны ранняя/первая стадия гемолимфатии и поздняя/вторая стадия менингоэнцефалита с поражением центральной нервной системы (ЦНС).
Самым ранним проявлением заболевания является кожный шанкр в месте инокуляции. Однако это случается редко у пациентов с T. brucei gambiense и нечасто (19%) у пациентов, инфицированных T. brucei rhodesiense. После этого развиваются системные симптомы:
- перемежающаяся лихорадка;
- головная боль;
- зуд и лимфаденопатия.
Лимфаденопатия может быть особенно заметной в заднем треугольнике шеи и получила эпоним «признак Уинтерботтома». Лихорадка часто сохраняется от дня до недели и разделена афебрильными интервалами от дней до месяцев. Волнообразная лихорадка отражает размножение паразитов в крови. Реже гепатоспленомегалия может возникать на ранней стадии. На поздней/второй стадии симптомы со стороны ЦНС проявляются в виде нарушений сна или нервно-психических расстройств. Нарушение сна — наиболее частый симптом второй стадии, и именно отсюда и был придан термин «африканская сонная болезнь». Проблемы со сном далее описываются как нарушение регуляции циклов сна/бодрствования и фрагментация сна. Ранее сообщалось об инверсии режима сна. Дополнительные симптомы включают:
- тремор;
- слабость;
- паралич;
- дискинезию;
- хорея-атетоз.
Может наблюдаться паркинсоническая гипертония и аномальные рефлексы. Могут присутствовать психические изменения, такие как агрессия, апатия, психоз или раздражительность. Могут быть вовлечены другие системы органов.
Щитовидная железа и кора надпочечников могут иметь гиперфункцию или гипофункцию. Оба они более выражены при инфекциях, вызванных T. brucei rhodesiense.
Клиническая конечная точка для любой подгруппы T. brucei приводит к коме и смерти при отсутствии лечения. Смерть наступает быстрее при заражении T. brucei rhodesiense, которое часто происходит в течение недель или месяцев, а при заражении T. brucei gambiense в среднем через 3 года после заражения.
Болезнь Шагаса имеет острую, неопределенную и хроническую стадии. Остро инфицированные пациенты часто протекают бессимптомно или имеют легкое неспецифическое лихорадочное заболевание. Симптомы могут включать:
- лихорадку;
- озноб;
- желудочно-кишечные проявления;
- лимфаденопатию;
- гепатоспленомегалию;
- или сочетание кожных проявлений.
Шагома — это затвердевшая, эритематозная папула или узелок, возникающий на месте инокуляции. Она может появиться через несколько недель после заражения. Симптомы Романа классически ассоциируются с острой болезнью Шагаса и характеризуются отеком век и периокулярным отеком, вторичным по отношению к отложениям паразитов в конъюнктиве. Шизотрипаниды — это термин, используемый для описания диффузной болезненной сыпи во время острой инфекции и наблюдается у меньшинства инфицированных пациентов.
Неопределенная стадия болезни Шагаса отражает иммунный ответ хозяина и уменьшение количества паразитов. Это происходит через несколько месяцев после заражения. В настоящее время антитела к T. cruzi присутствуют, а клиническая картина заболевания отсутствует.
Самая разрушительная стадия болезни — хроническая. До трети пациентов с болезнью Шагаса прогрессируют до этой стадии, которая проявляется нарушениями сердечной проводимости, дилатационной застойной сердечной недостаточностью или тромбоэмболическими явлениями. Сердечная недостаточность часто проявляется аневризматической дилатацией левого желудочка, а наиболее распространенным дефектом проводимости является блокада правой ножки пучка Гиса с передней фасцикулярной блокадой или без нее. Поражение желудочно-кишечного тракта (ЖКТ) встречается у меньшинства инфицированных пациентов, однако из них наиболее частым проявлением является мегаэзофагус в результате повреждения вегетативных ганглиев с последующей ахалазией, дисфагией, потерей веса или повторной аспирацией. Наконец, у пациентов с этим заболеванием со сниженным иммунитетом может возникнуть реактивация. Она может проявляться как рецидив лихорадки и кожных эритематозных узелков или бляшек наряду с менингоэнцефалитом.
Лечение
Лечение наиболее эффективно в раннем периоде болезни. Анализ клин, данных и результатов исследования цереброспинальной жидкости позволяет определить, вовлечена ли в патол. процесс ц. н. с. и в зависимости от этого выбрать тактику химиотерапии. В раннем периоде болезни, если ц. н. с. не поражена, применяют сурамин или пентами-дин. Сурамин показан для лечения обеих форм С. б. Его вводят внутривенно, готовя 10% р-р ex tempore в дозе до 20 мг!кг, но не более 1,0 г. Рекомендуется прерывистая схема введения: вначале — каждый второй, а в дальнейшем — каждый пятый или каждый седьмой день, всего 5 инъекций на курс. При болезнях почек сурамин не назначают. Лечение им проводят под контролем функции почек: появление умеренной лейкоциту рии (см.), протеину рии (см.) закономерно. Высокая протеинурия, цилиндрурия, появление эритроцитов в моче свидетельствуют о развитии токсического нефрита (см.) и служат показанием для прерывания курса химиотерапии.
Пентамидин эффективен только при гамбийской форме С. б. Его применяют внутримышечно в суточной дозе 3—4 мг!кг в течение 7—10 дней подряд или через день, на курс 8— 10 инъекций. Сурамин и пентамидин можно применять сочетанно.
В позднем периоде болезни применяют меларсопрол (арсобал) или другие мышьяковистые препараты, хорошо проникающие через гемато-энцефалический барьер в ткань мозга
Препарат отличается высокой эффективностью, но применять его следует с большой осторожностью, т. к
он может вызывать реактивную энцефалопатию с летальным исходом. Назначают в дозе 1,8— 3,6 мг/кг внутривенно в течение 3 сут. После недельного перерыва проводят второй такой же курс и при необходимости — третий. Препарат вводят строго в вену сухой иглой, т. к. при попадании даже капли его в кожу возникает сильное раздражение и длительный отек. Необходимо назначение дезинтоксикаци-онных, гипосенсибилизирующих, симптоматических средств.
Описание заболевания
О сонной болезни писал еще Жюль Верн в своих приключенческих романах. Он описывал заболевание с самой жуткой стороны, подробно описывая симптомы и последствия. И это не художественная выдумка, а чистая правда. Это действительно опасная инфекция, от которой раньше гибло по 8-10 тысяч человек в год. Большинство из них – жители Африки, но все, кто посещает эту страну, тоже оказываются в группе риска. Сегодня эпидемиологическая ситуация нормализовалась, но риск заразиться по-прежнему сохраняется.

Возбудитель
Другое название сонной болезни – африканский трипаносомоз. Такое название инфекция получила от лат. Trypanosoma brucei. Трипаносома – простейший организм, опасность которого заключается в особом механизме защиты от иммунитета хозяина. Проникнув в организм своей жертвы, трипаносома начинает активный синтез гликопротеинов, которые постепенно сменяют друг друга. Из-за такого режима иммунная система хозяина долго не может распознать паразита. За это время трипаносомы успевают размножиться настолько, что заболевание уже не проходит само собой.
Жизненный цикл паразита начинается в организме мухи цеце – основного переносчика сонной болезни. Через укус насекомого в организм человека проникает трипаносома, находящаяся на инвазионной стадии развития. Простейшие быстро разносятся по крови, лимфе и ликвору, вызывая интоксикацию. Часть паразитов проникает в кишечник, где они развиваются и размножаются.
Виды инфекции
На сегодняшний день паразитологи выявили две формы африканского трипаносомоза: гамбийскую (возбудитель Trypanosoma brucei gambiense) и родезийскую (возбудитель Trypanosoma brucei rhodesiense). Гамбийская сонная болезнь считается менее опасной. Заражаются ею во влажной местности близ рек и озер. Родезийская форма протекает с более тяжелыми симптомами. Мухи цеце, которые переносят такую инфекцию, обитают в саваннах.
Пути заражения
Как уже выяснилось, основной переносчик болезни – муха цеце. Длина насекомого от 7 до 9 мм. Цвет – рыжевато-серый с продольными полосками. Внешне цеце отличается от других мух особым складыванием крыльев: они не выпирают за пределы тельца, а аккуратно сложены вдоль него. Такие мухи нападают на всех теплокровных представителей живого мира, а также на прогретые автомобили.
Но чаще всего от мухи цеце страдают люди и крупный рогатый скот. Само насекомое только переносит африканский трипаносомоз, но никак от него не страдает. Покусав, например, антилопу, муха становится источником инфекции. И все последующие укушенные будут жертвами сонной болезни.
Теоретически, заразиться можно и через кровь больного человека: при обработке ран без перчаток, при переливании зараженной крови и т.д. Но это случается нечасто. Также известны случаи передачи инфекции половым путем и от матери к плоду.
Сонная болезнь – симптомы и лечение, фото и видео

Сонная болезнь – основные симптомы:
- Перепады настроения
- Слабость
- Боль в суставах
- Высыпания на коже
- Учащенное сердцебиение
- Увеличение селезенки
- Увеличение печени
- Увеличение лимфоузлов на шее
- Боль в мышцах
- Лихорадка
- Глазные кровоизлияния
- Розовые пятна на коже
- Снижение массы тела
- Отек век
- Отек лица
- Помутнение роговицы
- Красный узелок на коже
- Дневная сонливость
- Отек кистей
- Отек стоп
Причины сонной болезни возбудитель
Сонная болезнь относится к категории трансмиссивных трипаносомозов, характеризуется значительным ухудшением состояния больного и сильнейшим поражением лимфатической системы и ЦНС.
Основная причина, почему развивается патология заключается во внедрении в организм патологического агента.
На сегодняшний день существует 2 формы протекания, которые, соответственно, отличаются в зависимости от возбудителя. Провокаторами выступают простейшие из рода Trypanosoma brucei и Trypanosoma brucei rhodesiense. Не передается половым путем ни один из двух видов микроорганизмов.
Возбудитель сонной болезни обладает следующими особенностями:
- форма — плоская, продолговато-веретенообразная;
- размеры — ширина от 1,5 до 3,5 микрометра, длина — 12–35 микрометров;
- переносчик только муха цеце — кровососущее членистоногое, передающее инфекцию от одного человека к другому, может выделять болезнетворного агента на протяжении всей жизни.
Основные пути передачи заключаются в укусах мухи, которая выделяет паразита вместе со слюной. За один укус в организм может проникнуть примерно 400 тысяч особей, в то время как минимальной дозой, для возникновения специфической симптоматики выступает 300–400 трипаносом.
В среднем через 1–3 недели после того как начался жизненный цикл возбудителя, бактерии уже полностью поражают лимфатическую и кровяную систему, еще через некоторое время в патологию вовлекается ЦНС.
В ответ на это иммунная система начинает вырабатывать антитела, способные некоторое время сдерживать паразитемию. Однако у трипаносом высокая антигенная изменчивость, что нарушает процесс формирования иммунитета.
Пути передачи сонной болезни
Отмечается, что основную группу риска составляют:
- жители африканского континента;
- лица, занимающиеся земледелием и рыболовством;
- люди, связанные с охотой и животноводством;
- сельские жители.
Помимо африканского трипаносомоза, для людей представляет опасность американский трипаносомоз, который имеет название болезнь Шагаса.
Классификация
По мере прогрессирования сонной болезни трипаносомоз проходит несколько стадий:
- ранняя или гемолимфатическая — может продолжаться длительное время, от нескольких месяцев до 5 лет, в среднем примерно 1 год;
- среднетяжелая;
- тяжелая или менингоэнцефалитическая — паразит проникает в центральную нервную систему, что приводит к усугублению симптоматики и развитию осложнений.
Люди могут заразиться несколькими типами простейших микроорганизмов. Клиницисты выделяют несколько вариантов течения болезни:
- родезийский — возбудитель Trypanosoma brucei rhodesiense;
- гамбийский — источник Trypanosoma brucei.
Ни одна из болезней не передается половым путем.
Профилактика и прогноз
Избежать развития патологического процесса можно при строгом соблюдении некоторых правил. Профилактика сонной болезни включает такие рекомендации:
- истребление мухи цеце, которая выступает переносчиком паразитов;
- вырубка кустарниковых зарослей, растущих вблизи населенных пунктов;
- отказ от посещения стран Африки без крайней на то надобности;
- осуществление среди местных жителей и туристов массовой хлорпрофилактики;
- использование репеллентов при каждом выходе на улицу;
- ношение светлой одежды с длинными рукавами;
- выполнение внутримышечной инъекции «Пентамидина» раз в полгода.
При полном отсутствии терапии сонная болезнь в 100 % случаев приводит к летальному исходу. При начале специфического лечения на ранней стадии возможно полное излечение. Если терапия была проведена при вовлечении в патологический процесс нервной системы, не исключается вероятность развития осложнений, которые приводят к смерти.
Помимо сроков начала медикаментозного устранения такой проблемы, на исход влияет форма — родезийский вариант обладает более серьезным прогнозом.
Если Вы считаете, что у вас Сонная болезнь и характерные для этого заболевания симптомы, то вам могут помочь врачи: инфекционист, терапевт, педиатр.
Источник
Лечение
Лечение Trypanosoma brucei gambiense и T. brucei rhodesiense отличается, и, кроме того, терапия зависит от стадии инфекции.
При первой стадии заболевания, вызванного T. brucei gambiense, пентамидин является терапией первой линии. Путь введения: внутримышечно в течение одной недели или внутривенно с физиологическим раствором в течение 2 часов. Три инъекции по сравнению с длительной терапией могут быть одинаково эффективными. Как только обнаруживается поражение спинномозговой жидкости, пентамидин перестает действовать. Побочные эффекты пентамидина включают реакции в месте инъекции, боль в животе и гипогликемию. Более серьезные побочные эффекты, наблюдаемые при применении пентамидина при лечении других заболеваний, включают лейкопению, тромбоцитопению, гиперкалиемию и удлинение интервала QT.
Заболевание второй стадии, вызываемое T. brucei gambiense, включает эфлорнитин или меларсопрол. Было показано, что эфлорнитин превосходит меларсопрол в снижении смертности и, следовательно, является предпочтительным лекарством для лечения второй стадии заболевания. Комбинация нифуртимокса и эфлорнитина снижает дозировку и стоимость терапии. Побочные реакции аналогичны эфлорнитину и включают панцитопению, расстройство желудочно-кишечного тракта и судороги.
Первая стадия заболевания, вызванного T. brucei rhodesiense, лечится сурамином. Хотя сурамин также эффективен при заболеваниях, вызываемых T. brucei gambiense, высокая распространенность онхоцеркоза (речная слепота) в этих регионах и риск тяжелой аллергической реакции на сурамин запрещают ее использование в Западной и Центральной Африке. Для первой стадии болезни, вызванной T. brucei rhodesiense сурамин используется в течение до 30 дней. Примечательно, что это лекарство быстро разлагается в воздухе, и его необходимо вводить сразу после разбавления дистиллированной водой. Побочные реакции на сурамин включают реакции гиперчувствительности, нефротоксичность, периферическую нейропатию, токсичность для костного мозга и последующий агранулоцитоз и/или тромбоцитопению.
Вторую стадию болезни, вызванной T. brucei rhodesiense можно лечить меларсопролом. Побочные реакции могут быть тяжелыми, включая энцефалопатический синдром, у 8% пациентов. В этом случае используется дексаметазон и диазепам. Кожные реакции, включая зуд и пятнисто-папулезную сыпь проявляются часто, а буллезные поражения возникают редко. Могут возникнуть моторные и сенсорные нейропатии.
Лечение болезни Шагаса уникально тем, что используются 2 нитрогетероциклических соединения. Это бензнидазол и нифуртимокс, причем первый предпочтительнее из-за его благоприятного профиля побочных эффектов. Дозировка бензнидазола составляет 5 мг/кг в день в течение 60 дней, нифуртимокс назначают от 8 до 10 мг/кг в день для взрослых, 12,5 мг/кг в день для подростков и от 15 до 20 мг/кг в день для детей. Все продолжительностью от 90 до 120 дней. Побочные эффекты бензнидазола включают светочувствительность, тяжелый эксфолиативный дерматит, периферическую нейропатию и угнетение костного мозга. Это требует полной метаболической панели, панели функции печени и общего анализа крови, причем последний повторяется каждые две недели во время лечения. Побочные эффекты нифуртимокса включают расстройство желудочно-кишечного тракта, периферическую нейропатию и расстройства настроения. Полный анализ крови, печеночная функциональная панель и полная метаболическая панель должны быть получены с оценкой периферической нейропатии каждые 2 недели во время лечения.
Меры профилактики
К сожалению, на сегодняшний день не существует специальной вакцины от данного заболевания, однако в ряде африканских городов принимают противопротозойные препараты с профилактической целью. При поездке в Южную Америку или Африку рекомендуется брать с собой средства, отпугивающие мух и клопов, а также обрабатывать ими одежду.
В настоящее время в странах, где высок риск заражения, принимаются меры по уничтожению мух Цеце и клопов-переносчиков. Подобные методы являются самыми эффективными и дают хорошие результаты, снижая риск попадания возбудителя заболевания в кровеносную систему.
Трипаносомоз — сложное заболевание, которое порой в течение длительного времени не даёт о себе знать, но иногда проявляется достаточно быстро. Течение процесса сложное. Существует высокая вероятность летального исхода. Особенно болезнь опасна для беременных женщин, потому что в большинстве случаев происходит выкидыш.
Загадочная эпидемия в Казахстане
Сонная болезнь обрушилась и на село Калачи в Казахстане. Несколько лет не могли найти разгадку странных обстоятельств. Всё началось с того, что жители деревни стали буквально засыпать на ходу на сутки, а то и на неделю! Причём пациенты больницы – люди разной социальной принадлежности, разного возраста и пола. Они не контактировали друг с другом, поэтому вариант вирусного заболевания не рассматривался.
За год – десятки жертв. При населении количеством 600 человек – это немалое число. Учёными проведено около 7000 исследований безрезультатно. Деревню Казахстана окутывают панические настроения: люди продают дома и переезжают.
По словам пенсионерки Эльзы Рерих, она постоянно испытывает сонливость, усталость, веки закрываются. После того как она случайно заснула в гостях у сына, медикам удалось её разбудить лишь спустя несколько дней. То же самое произошло с жителем Калачей Виктором Макаровым, двухлетним ребёнком и девятиклассником, заснувшим прямо на уроке.
Многие жалуются на головокружения, ухудшение зрения, тремор и галлюцинации. Диагностика не выявила серьёзных отклонений здоровья пациентов. В отчаянии местные жители ссылаются на кару небесную или проявление инопланетных сил. У работников санитарно-эпидемиологической экспертизы иная версия.
В СССР в Калачах находились урановые шахты, поэтому спровоцировать сонное явление мог повышенный уровень радиации. Замеры в руднике показали, что гамма-фон в норме, так же, как и санитарно-гигиенические нормативы.
Поэтому какие именно явления вызывают сонный синдром, до сих пор не выявлено. Над этим вопросом работают медики, работники МЧС, министры здравоохранения, геологи. Местные жители отмечают, что пик сонливости приходится на зимне-весенний период.
Иммунитет
Человек обладает естественным иммунитетом (см.) ко многим видам африканских трипаносом, поражающих животных, и восприимчив только к Т. gambiense и Т. rhodesiense. Перенесенное заболевание не оставляет после себя стойкого иммунитета.
Одним из факторов, нарушающих развитие специфического иммунитета при С. б., является антигенная изменчивость трипаносом по ходу инвазии. Образующиеся антитела, специфичные по отношению к данному антигенному варианту паразита, подавляют его численность, но не действуют на новый вариант. При экспериментальном трипаносомозе по ходу инвазии удавалось выявить до тридцати трех антигенных вариантов трипаносом. Вследствие этого инвазия непрерывно прогрессирует без тенденции к самоизлечению. По причинам антигенной изменчивости возбудителей пока не удалось разработать метода специфической иммунопрофилактики С. б.
Деятельность ВОЗ
С 1990-х гг. достигнуты значительные успехи в борьбе с паразитами и переносчиками болезни в Латинской Америке, а именно на территории Южного конуса, Центральной Америки, стран Андского пакта и стран Амазонских межправительственных инициатив с участием
Секретариата Панамериканской организации здравоохранения. Эти международные инициативы привели к значительному уменьшению масштабов передачи инфекции и расширению доступа к средствам диагностики и противопаразитарного лечения.
Кроме того, существенно снижен риск передачи инфекции при переливании крови путем проведения всеобщего скрининга во всех банках крови в странах Латинской Америки, а также в большинстве европейских стран и стран Западной части Тихого океана, где регистрируются
случаи заболевания. Эти достижения стали возможными благодаря твердой приверженности государств-членов, затронутых этой болезнью, а также наращиванию потенциала их организаций в области научных исследований и борьбы с этой болезнью при поддержке со
стороны многих международных партнеров.
В 2005 г. болезнь Шагаса была признана Всемирной организацией здравоохранения одной из забытых тропических болезней. Это способствовало более широкому пониманию значимости этой болезни на международном уровне и позволило бороться с дезинформацией, отсутствием
социального спроса и недостаточной политической приверженности решению проблем, связанных с болезнью Шагаса, а также с недостаточным объемом научных исследований и разработок, касающихся профилактики, выявления и оказания комплексной помощи, включая
диагностику, лечение, информирование о лекарственных препаратах, социальные аспекты, просвещение, образование и средства коммуникации.
В то же время необходимо решать ряд дополнительных проблем, таких как:
- поддержание и усиление прогресса, достигнутого в борьбе с этой болезнью и ее профилактике;
- возникновение болезни Шагаса в районах, считавшихся ранее свободными от этой болезни, таких как бассейн Амазонки;
- повторное возникновение болезни в районах, где проводилась борьба с переносчиками, таких как район Чако в Аргентине и Многонациональное Государство Боливия;
- распространение болезни главным образом в результате роста мобильности населения между Латинской Америкой и остальным миром;
- предупреждение последствий неосведомленности, стигматизации и/или дискриминации в отношении этой болезни; и
- расширение доступа миллионов инфицированных людей к диагностике и лечению.
Для достижения цели по элиминации передачи болезни Шагаса и предоставлению медицинской помощи для инфицированных или больных людей как в эндемичных, так и в неэндемичных районах, ВОЗ стремится расширить создание сетей на глобальном уровне и усилить региональный
и национальный потенциал, уделяя основное внимание таким мерам, как:
- усиление систем эпиднадзора и информационных систем в мире;
- повышение уровня информированности о болезни Шагаса и затронутых группах населения;
- предупреждение передачи инфекции при переливании крови и пересадке органов;
- содействие разработке наиболее эффективных диагностических тестов и алгоритмов/протоколов для расширения скрининга и диагностирования инфекции;
- расширение мер первичной профилактики передачи врожденной инфекции и ведения случаев врожденной и неврожденной инфекции;
- содействие достижению консенсуса в отношении надлежащего ведения случаев заболевания с помощью новейших методов; и
- содействие разработке комплексных подходов с учетом множества аспектов.
(1) Аргентина, Белиз, Боливия (Многонациональное Государство), Бразилия, Чили, Колумбия, Коста-Рика, Эквадор, Сальвадор, Французская Гайана, Гватемала, Гайана, Гондурас, Мексика, Никарагуа, Панама, Парагвай, Перу, Суринам, Уругвай и Венесуэла (Боливарианская Республика).
Возбудитель трипаносомоза
Возбудитель трипаносомоза — это паразит, относящийся к жгутиковым, имеющий одноимённое название с вызываемой им болезнью – трипаносома. У всех возможных вариантов данной патологии существует общий вид возбудителя, но разные его типы, однако для всех трипаносом характерны следующие признаки:
— Обладают полиморфизмом, то есть при смене хозяев также претерпевают некоторые изменения в строении.
— Попадая в организм мухи цеце при кровососании, проникают в желудок, активно там реплицируются и далее принимают форму эпимастиготы при проникновении в слюнные железы переносчика.
— В течение некоторого времени они, находясь в слюнных железах, претерпевают превращение в контагиозные формы трипомастигот, которые уже способны заражать других млекопитающих при их укусе данным видом мухи.
— Попадая в организм млекопитающего, трипомастиготы вновь делятся с формированием трипаносом двух видов, длинных и коротких, на поверхности которых имеется гликопротеидный антиген.
Трипаносомоз американский, как и все иные виды заболеваний, возникает при заражении одним общим видом трипаносомы, но различия существуют лишь в вариантах данного вида. Преимущественный путь передачи трипаносомоза – это трансмиссивный, то есть во время укусов мухами и клопами, относящимися к определённым видам. Однако в результате длительного изучения данной патологии был установлен также контактный путь передачи трипаносомоза, гемотрансфузионный.
Гамбийский трипаносомоз возникает при укусах мухой цеце и является разновидностью такого типа трипаносомоза, как африканский.
Трипаносомоз американский или болезнь Шагаса возникает при укусах клопов, которые принадлежат к семейству хищнецов. Различия между всеми этими патологиями связаны не только с разнообразными переносчиками и поражаемыми млекопитающими, но и в типичной встречаемости инфекции в определённых районах местности и даже континентах. Так, к примеру, трипаносомоз африканский регистрируется именно в Африке, а американский регистрируется только в странах Латинской Америки, что и обуславливает их название. Зачастую для трипаносомозов характерны не только единичные случаи диагностирования, но и массовые регистрируемые вспышки инфекции, что, может быть обусловлено вариантом бессимптомного носительства этих паразитов.
Также установлена возможность течения африканского трипаносомоза остро и хронически, что и обуславливает значительную разницу в клинике проявляющихся симптомов.
Патогенез трипаносомозов любого типа заключается в активном проникновении возбудителей при укусах переносчиками в организм человека и распространении по кровеносной системе, характерным формированием новых антигенных вариантов на поверхности паразитов по мере развития симптоматики, что и вызывает длительное течение инфекции. В случае отсутствия патогенетического лечения, возбудители способны поражать нервную систему человека, а также сердечно-сосудистую, вызывая порой необратимые воспалительные реакции, что может в итоге приводить к гибели пациентов. Нередко диагностируются случаи проявления признаков заражения только спустя несколько лет после инфицирования, что обусловлено переходом инфекции в латентную форму.
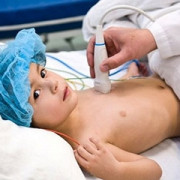
Подтверждение диагноза
Проживание в регионах с высоким риском заражения, а также характерные симптомы позволяют заподозрить сонную болезнь. Следует, однако, помнить, что заболевание не всегда проявляется яркой клиникой. Начальные стадии болезни могут иметь смазанную клиническую картину с неспецифическими симптомами. Так, гамбийская форма характеризуется длительным течением с медленным ухудшением состояния. Гемолимфатическая стадия способна затягиваться на многие месяцы, периодически обостряясь. Родезийская же форма сонной болезни прогрессирует быстро, приводя к появлению неврологической симптоматики и смертельному исходу не позднее одного года после заражения.
Так или иначе, даже специфические клинические проявления не могут служить достаточным основанием для подтверждения диагноза. Требуется обнаружить паразита в организме больного. Учитывая особенности его распространения в теле окончательного хозяина, выявить возбудителя можно:
- в содержимом шанкра,
- пунктате лимфоузлов,
- мазке крови,
- спинномозговой жидкости.
Последний пункт важен для установления стадии болезни. Появление трипаносом в ликворе свидетельствует о том, что паразит проник через гематоэнцефалический барьер.